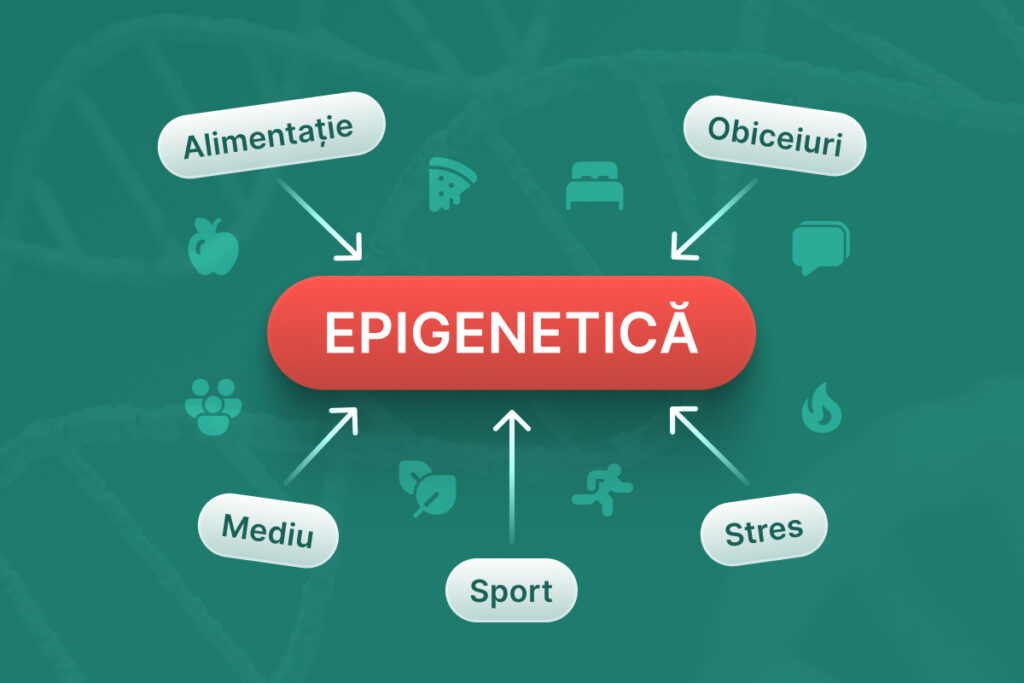
Epigenetica este o ramură a biologiei moderne, care explorează modul în care factorii externi influențează exprimarea genelor fără a modifica secvența ADN-ului. Epigenetica evidențiază faptul că nu doar secvențele de ADN influențează activitatea genelor, ci și „comutatoarele epigenetice” care reglează când și cum sunt exprimate aceste gene.
Aprofundarea mecanismelor epigenetice ne oferă perspective inovatoare asupra prevenției, diagnosticului și tratamentului unui spectru larg de boli, promițând o abordare mai personalizată și eficientă a medicinei moderne.
Prin explicarea interacțiunilor dintre mediul nostru și genom, epigenetica ne învață cum stilul de viață și mediul înconjurător contribuie la starea noastră de sănătate și la predispoziția pentru diverse afecțiuni, pavând drumul către o medicină care nu doar tratează, ci protejează și conservă sănătatea umană.
Ce este epigenetica?
Epigenetica este o ramură a biologiei moleculare care explorează modul în care factorii externi, precum comportamentele și mediul pot provoca schimbări ce influențează funcționarea genelor.
Epigenetica se referă la modificările funcției genelor care sunt ereditare sau dobândite și care nu implică o schimbare a secvenței ADN-ului. În esență, aceasta studiază “întrerupătoarele” care activează sau inactivează genele, fără a altera codul genetic în sine [1].
Prin intermediul epigeneticii, cercetătorii pot înțelege cum anumiți factori, cum ar fi dieta, stresul și expunerea la poluanți, pot modifica expresia genică, adică modul în care informația genetică este utilizată în dezvoltarea și funcționarea organismelor. Aceste modificări pot avea efecte profunde asupra sănătății și pot fi, în unele cazuri, transmise și următoarelor generații.
Termenul „epigenetică” provine din greacă, unde prefixul „epi-” înseamnă „peste” sau „deasupra”, subliniind astfel ideea că epigenetica reprezintă un strat suplimentar de instrucțiuni care controlează expresia genelor. Această denumire accentuează faptul că, deși genele sunt esențiale pentru codificarea trăsăturilor biologice, mecanismele epigenetice joacă un rol important în modul și momentul în care informațiile genetice sunt utilizate, influențând funcția celulară fără a modifica secvența de bază a ADN-ului.
Mecanismele principale ale reglării epigenetice
Metilarea ADN-ului
Metilarea ADN-ului implică adăugarea grupărilor metil la nivelul situsurilor CpG din molecula de ADN, proces predominant asociat cu inhibarea expresiei genetice. Această modificare epigenetică este una dintre cele mai studiate și are un rol important în funcționarea normală a organismului și în patologia umană.
Metilarea ADN-ului poate conduce la silențierea expresiei genelor fără a altera secvența de bază, afectând modul în care celulele accesează codul genetic conținut în ADN.
Modificările proteinelor histonice
Histonele sunt proteine în jurul cărora ADN-ul este împachetat, formând o structura denumită nucleozom. Modificările chimice ale histonelor, cum ar fi acetilarea sau metilarea, influențează gradul de înfășurare a ADN-ului în jurul acestor proteine.
Astfel, modificările proteinelor histonice pot regla accesul factorilor de transcripție la ADN, facilitând sau inhibând expresia genică. Aceste ajustări sunt esențiale pentru controlul temporal și spațial al activității genelor în cadrul diferitelor tipuri celulare și stadii de dezvoltare.
ARN-ul non-codant
ARN-urile non-codante sunt molecule de ARN care nu sunt traduse în proteine, dar care au roluri importante în reglarea expresiei genelor. Aceste molecule pot modula activitatea genetică prin diverse mecanisme, inclusiv prin interferența ARN (ARNi), care implică tăierea sau blocarea mesajelor ARN mesager ce codifică proteine.
Alte forme de ARN non-codant, precum ARN-ul lung non-codant (lncARN), pot servi ca „șabloane” pentru adunarea complexelor de remodelare a cromatinei, influențând structura acesteia și, implicit, activitatea genetică.
Mecanisme de reglare epigenetică sunt fundamentale pentru adaptabilitatea și diversitatea fenotipică a organismelor fără schimbări în codul genetic propriu-zis, evidențiind complexitatea suplimentară a reglării genetice care transcende secvența ADN.
Aceste procese permit celulelor să răspundă și să se adapteze la schimbările mediului, având implicații majore în sănătatea și patologia umană [2].
Studiul foametei olandeze: Un exemplu semnificativ pentru epigenetică
Studiul foametei olandeze, un exemplu notoriu în domeniul epigeneticii, explorează efectele nutriției prenatale asupra sănătății pe termen lung. În iarna anului 1944-1945, Olanda a suferit o perioadă de foamete extremă din cauza restricțiilor alimentare impuse în timpul celui de-al Doilea Război Mondial.
Modificările epigenetice induse de foamete
Cercetările ulterioare pe persoanele care au fost expuse in utero la foamete au arătat că acestea au dezvoltat modificări epigenetice semnificative, precum modele de metilare alterate ale genelor implicate în creșterea organismului și metabolism și o îmbătrânire biologică accelerată măsurată prin ceasul biologic DunedinPACE [3].
Aceste schimbări au avut implicații majore asupra sănătății lor, crescând incidența obezității, diabetului de tip 2, bolilor cardiovasculare și chiar a unor tulburări mentale cum ar fi schizofrenia și demența [4][5][6].
Implicațiile epigeneticii în longevitate
Epigenetica joacă un rol semnificativ în procesele de îmbătrânire și longevitate, oferind perspective noi asupra modului în care modificările reglării genelor pot influența durata de viață și calitatea acesteia. Studiile recente sugerează că anumite modificări epigenetice pot contribui la îmbătrânirea sănătoasă sau, dimpotrivă, la declinul sănătății asociat cu vârsta.
Epigenetica și longevitatea
Metilarea ADN-ului, în mod special, a fost asociată cu procesele de îmbătrânire. Un „ceas epigenetic”, bazat pe modelele de metilare a ADN-ului, poate prezice vârsta biologică a unei persoane, care poate diferi semnificativ de vârsta cronologică în funcție de expunerea la factori de mediu și stil de viață.
Persoanele cu o vârstă biologică mai mică decât cea cronologică tind să prezinte o sănătate mai bună și o speranță de viață mai lungă. Modificările benefice ale profilului de metilare pot fi stimulate de factori precum o nutriție adecvată, activitate fizică regulată și un mediu redus în stres.
Mecanismele epigenetice și declinul funcțional
Acumularea de modificări epigenetice nefavorabile poate contribui la declinul funcțional asociat cu îmbătrânirea. Alterările în metilarea ADN-ului și modificările histonelor pot afecta expresia genelor implicate în repararea ADN-ului, inflamație și diverse funcții metabolice celulare, accelerând deteriorarea funcțională a celulelor și țesuturilor.
Aceste modificări pot facilita dezvoltarea bolilor legate de vârstă, cum ar fi afecțiunile cardiovasculare, diabetul de tip 2 și unele forme de cancer.
Intervenții epigenetice pentru longevitate
Înțelegerea mecanismelor epigenetice care contribuie la îmbătrânire deschide calea pentru dezvoltarea intervențiilor care pot modifica aceste procese.
De exemplu, unii agenți farmacologici care influențează metilarea ADN-ului sau modificările histonelor pot avea potențialul de a întârzia debutul bolilor legate de vârstă sau de a îmbunătăți funcția celulelor senescente (îmbătrânite).
Însă nu doar intervențiile farmacologice au fost asociate cu o îmbunătățire a profilului epigenetic. Intervenții alimentare și de stil de viață precum dieta mediteraneană, activitatea fizică regulată, somnul de calitate au fost asociate cu o îmbătrânire epigenetică mai lentă.
Epigenetica și testele de vârstă biologică
Una dintre cele mai promițătoare aplicații ale epigeneticii în medicina modernă este utilizarea testelor de vârstă biologică pentru a evalua starea generală de sănătate și riscul de boli asociate cu îmbătrânirea.
Aceste teste, bazate pe modificările epigenetice, oferă o perspectivă detaliată asupra modului în care corpul nostru îmbătrânește comparativ cu vârsta cronologică.
Ce sunt testele de vârstă biologică?
Testele de vârstă biologică măsoară metilarea ADN-ului la anumite locații din genom care s-au dovedit a fi indicatori sensibili ai vârstei biologice. Aceste „ceasuri epigenetice” pot oferi informații despre cât de repede îmbătrânește organismul unui individ în comparație cu vârsta sa cronologică.
Divergențele între acești doi parametri pot indica o sănătate mai bună sau mai slabă și un risc crescut sau diminuat de boli asociate cu îmbătrânirea.
Implicații și utilizări
Utilizarea testelor de vârstă biologică poate revoluționa modul în care medicii previn și tratează bolile legate de vârstă. Prin identificarea persoanelor cu îmbătrânire accelerată, aceste teste permit intervenții precoce personalizate, precum modificări ale dietei, activității fizice, stilului de viață, administrarea unor suplimente și instituirea unor tratamentele medicale, care pot încetini procesul de îmbătrânire și îmbunătăți calitatea vieții.
Mai mult, prin posibilitatea repetării analizei la o perioadă de timp, aceste teste pot fi folosite pentru a monitoriza eficacitatea diferitelor intervenții anti-îmbătrânire, oferind un feedback valoros asupra modului în care modificările stilului de viață sau terapiile noi influențează epigenomul.
Epigenetica în diagnostic și prevenție
Epigenetica se dovedește a fi o unealtă valoroasă pentru diagnosticarea precoce și prevenția personalizată a bolilor, prin identificarea markerilor epigenetici specifici care pot indica predispoziția la anumite afecțiuni sau stadiul de dezvoltare a acestora.
Diagnosticarea precoce folosind markerii epigenetici
Markerii epigenetici, cum ar fi modelele de metilare a ADN-ului sau profilurile de expresie ale ARN-ului non-codant, pot fi folosiți pentru a detecta bolile în stadii incipiente, când tratamentul poate fi mai eficient. De exemplu, un test de screening de sânge aprobat de FDA (Food and Drug Administration) identifică gena SPTN metilată, un biomarker asociat cancerului colorectal.
Astfel de teste non-invazive care folosesc probe de sânge sau materii fecale vor schimba prevenția și tratamentul cancerelor, oferind o fereastră critică pentru intervenție timpurie și personalizată.
Prevenția personalizată bazată pe profilul epigenetic
De asemenea, profilul epigenetic al unei persoane poate furniza informații despre riscurile sale specifice de sănătate, permițând elaborarea unor planuri de prevenție personalizate. Intervențiile pot include modificări ale alimentației și stilului de viață care sunt cunoscute a influența epigenomul.
De exemplu, studiile au arătat că dieta mediteraneană poate induce modificări benefice în metilarea ADN-ului asociată cu reducerea riscului de boli cardiovasculare [7].
Rolul epigeneticii în vaccinare și răspunsul la tratament
Epigenetica are implicații și în eficacitatea vaccinurilor și a altor forme de terapie. De exemplu, modificările epigenetice pot influența modul în care un individ răspunde la vaccinarea împotriva gripelor sau alte infecții, oferind baze pentru optimizarea strategiilor de vaccinare [8].
De asemenea, înțelegerea modului în care profilul epigenetic afectează răspunsul la medicamente poate conduce la ajustarea dozelor și la alegerea celor mai eficiente terapii pentru fiecare pacient în parte, maximizând eficacitatea tratamentului și minimizând efectele secundare.
Factorii externi și epigenetica
Interacțiunea dintre factorii externi și epigenetică este un domeniu de cercetare intensiv despre cum mediul înconjurător poate influența expresia genelor și sănătatea pe termen lung. Acești factori includ dieta, stresul, expunerea la substanțe chimice și chiar interacțiunile sociale, fiecare având potențialul de a modifica epigenomul.
Impactul dietei și nutriției asupra epigeneticii
Alimentația joacă un rol crucial în modificarea epigeneticii. Nutrienți specifici, cum ar fi folatii, vitamina B12, și metionina, sunt esențiali pentru procesul de metilare a ADN-ului. O deficiență sau un surplus de anumiți nutrienți poate influența epigenomul și poate avea implicații pe termen lung asupra riscului de boli cronice, cum ar fi cele cardiovasculare, diabetul și diferite forme de cancer.
De exemplu, studiile au indicat că un aport crescut de alimente bogate în compuși bioactivi, cum sunt cele din dieta mediteraneană, este asociat cu un profil epigenetic favorabil în prevenirea bolilor cronice.
Efectele sportului
Exercițiile fizice pot induce modificări epigenetice care îmbunătățesc funcționarea metabolismului, reduc inflamația și pot chiar modifica expresia unor gene implicate în stresul oxidativ și repararea ADN-ului.
Studiile arată că sportul poate influența metilarea ADN-ului și modificările proteinelor histonice, contribuind astfel la prevenirea bolilor cronice cum ar fi obezitatea, diabetul de tip 2 și unele forme de cancer. Activitatea fizică îmbunătățește starea fizică imediată și modulează pe termen lung expresia genetică, oferind beneficii durabile.
Stresul și modificările epigenetice
Stresul, fie că este fizic sau psihologic poate avea efecte semnificative asupra profilului epigenetic. Cercetările au arătat că stresul cronic poate modifica expresia genelor printr-o serie de căi, inclusiv prin metilarea ADN-ului și prin mecanisme mediate de ARN non-codant.
Aceste modificări pot contribui la dezvoltarea tulburărilor psihice și a bolilor metabolice, subliniind importanța managementului stresului în strategiile de prevenție și tratament.
Somnul și epigenetica
Lipsa somnului sau un somn de proastă calitate poate conduce la modificări epigenetice care afectează reglarea metabolică, funcția imunitară și reacțiile la stres. Modificările în metilarea ADN-ului și profilurile ARN-ului non-codant asociate cu privarea de somn pot crește susceptibilitatea la afecțiuni precum obezitatea, diabetul și depresia.
De asemenea, somnul insuficient poate influența negativ metilarea genelor implicate în ciclurile circadiene, perturbând ritmurile naturale ale organismului și exacerbând riscurile pentru boli cronice. Un somn de o durată și calitate adecvate este vital nu doar pentru recuperarea zilnică, ci și pentru menținerea unui profil epigenetic sănătos care promovează longevitatea și bunăstarea generală.
Poluanții și expunerea la substanțe chimice
Expunerea la poluanți și substanțe chimice, cum ar fi metalele grele, bisfenolul A (BPA) și pesticidele, poate afecta epigenomul. Aceste substanțe pot induce modificări epigenetice care alterează funcționarea normală a genelor și pot crește riscul de afecțiuni, inclusiv afectări neurologice și cancer.
Monitorizarea și reglementarea expunerii la aceste substanțe chimice sunt esențiale pentru protejarea sănătății publice la nivel epigenetic [9].
Epigenetica și îmbătrânirea populației
Studiile asupra epigeneticii au început să dezvăluie modul în care factorii de mediu influențează îmbătrânirea. Modificările epigenetice care apar pe parcursul vieții pot fi acceleratoare ale procesului de îmbătrânire sau, invers, pot contribui la longevitate, în funcție de natura și intensitatea acestor factori externi.
Epigenetica și bolile complexe
Epigenetica are un rol fundamental în înțelegerea și tratamentul bolilor complexe, inclusiv cancerul, bolile neurodegenerative și afecțiunile autoinflamatorii. Modificările epigenetice pot influența dezvoltarea și progresia acestor boli prin alterarea expresiei genelor și perturbarea proceselor celulare normale.
Epigenetica și cancerul
În cazul cancerului, modificările epigenetice precum hipermetilarea ADN-ului pot duce la inactivarea genelor supresoare tumorale, facilitând astfel proliferarea celulară necontrolată. Pe de altă parte, hipometilarea poate activa genele oncogene.
Terapii epigenetice precum 5-Azacytidine, Decitabine, Vorinostat, Panobinostat, care vizează aceste modificări specifice sunt aprobate, iar altele sunt în curs de dezvoltare și promit revoluționarea tratamentului oncologic prin reactivarea genelor supresoare tumorale și inhibarea genelor care promovează proliferarea tumorală.
Bolile neurodegenerative
În bolile neurodegenerative, cum sunt Alzheimer și Parkinson, modificările epigenetice pot influența expresia genelor implicate în procesele neuroinflamatorii și în metabolismul neuronal. Studiile au arătat că anumite modificări ale histonelor și metilării ADN-ului pot afecta plasticitatea neuronală și funcționarea sinaptică, contribuind la apariția acestor boli.
Intervențiile epigenetice care corectează aceste modificări pot oferi noi direcții terapeutice pentru ameliorarea simptomelor și încetinirea progresiei bolii.
Afecțiunile cardiovasculare
În cazul afecțiunilor cardiovasculare, epigenetica joacă un rol în reglarea genelor implicate în inflamație, proliferarea celulară și metabolismul lipidic. Modificările epigenetice pot fi induse de factori de risc tradiționali, cum ar fi hipertensiunea, obezitatea și fumatul, precum și de stilul de viață și dieta.
Înțelegerea acestor mecanisme poate facilita dezvoltarea de strategii preventive și terapeutice personalizate, inclusiv modificări ale stilului de viață și tratamente farmacologice țintite.
Provocările și oportunitățile în tratarea bolilor complexe
Deși epigenetica oferă oportunități valoroase pentru managementul bolilor complexe, există provocări semnificative în aplicarea cunoștințelor epigenetice în practica clinică. Complexitatea mecanismelor epigenetice, variabilitatea răspunsurilor individuale la intervenții și dificultatea în monitorizarea modificărilor epigenetice în timp real sunt doar câteva dintre aceste provocări.
Contribuția epigeneticii în medicina personalizată
Epigenetica, prin studiul modificărilor genetice care nu afectează secvența ADN, oferă o înțelegere profundă asupra modului în care factorii de mediu și stilul de viață influențează sănătatea umană. Această ramură a biologiei moleculare are potențialul de a revoluționa prevenția, diagnosticul și tratamentul bolilor, permițând dezvoltarea de strategii medicale personalizate.
Întrucât epigenetica ne permite să vedem dincolo de genele noastre în direcția unui viitor în care medicina este adaptată nevoilor individuale, ea devine un pilon esențial în evoluția spre o abordare mai eficientă și mai proactivă a sănătății. Prin integrarea cunoștințelor epigenetice, medicina modernă se poate orienta nu doar spre tratamentul simptomelor, ci și spre optimizarea sănătății pe termen lung, pentru o viață mai bună.
Referințe:
- 1.Dupont C, Armant DR, Brenner CA. Epigenetics: definition, mechanisms and clinical perspective. Semin Reprod Med. 2009 Sep;27(5):351-7. doi: 10.1055/s-0029-1237423. Epub 2009 Aug 26. PMID: 19711245; PMCID: PMC2791696.
- 2.Wu, YL., Lin, ZJ., Li, CC. et al. Epigenetic regulation in metabolic diseases: mechanisms and advances in clinical study. Sig Transduct Target Ther 8, 98 (2023). https://doi.org/10.1038/s41392-023-01333-7
- 3.Cheng M, Heijmans B, Li C, Lumey L, Ryan C, Wang S, Zhou J, Belsky D. IN UTERO EXPOSURE TO THE DUTCH HUNGER WINTER AND THE PACE OF BIOLOGICAL AGING. Innov Aging. 2023 Dec 21;7(Suppl 1):206. doi: 10.1093/geroni/igad104.0680. PMCID: PMC10736709.
- 4.Ravelli GP, Stein ZA, Susser MW. Obesity in young men after famine exposure in utero and early infancy. N Engl J Med. 1976 Aug 12;295(7):349-53. doi: 10.1056/NEJM197608122950701. PMID: 934222.
- 5.Bleker LS, de Rooij SR, Painter RC, van der Velde N, Roseboom TJ. Prenatal Undernutrition and Physical Function and Frailty at the Age of 68 Years: The Dutch Famine Birth Cohort Study. J Gerontol A Biol Sci Med Sci. 2016 Oct;71(10):1306-14. doi: 10.1093/gerona/glw081. Epub 2016 May 4. PMID: 27146370.
- 6.Wiegersma AM, Boots A, van Bussel EF, Lissenberg BI, Nielen MMJ, Roseboom TJ, de Rooij SR. Prenatal Exposure to the 1944-45 Dutch Famine and Risk for Dementia up to Age 75: An Analysis of Primary Care Data. Curr Alzheimer Res. 2024 May 3. doi: 10.2174/0115672050290699240422050036. Epub ahead of print. PMID: 38706355.
- 7.Estruch, R., Ros, E., Salas-Salvadó, J., et al. (2013). Primary Prevention of Cardiovascular Disease with a Mediterranean Diet. New England Journal of Medicine, 368(14), 1279-1290.
- 8.Bannister S, Messina NL, Novakovic B, Curtis N. The emerging role of epigenetics in the immune response to vaccination and infection: a systematic review. Epigenetics. 2020 Jun-Jul;15(6-7):555-593. doi: 10.1080/15592294.2020.1712814. Epub 2020 Mar 17. PMID: 31914857; PMCID: PMC7574386.
- 9.Cheng TF, Choudhuri S, Muldoon-Jacobs K. Epigenetic targets of some toxicologically relevant metals: a review of the literature. J Appl Toxicol. 2012 Sep;32(9):643-53. doi: 10.1002/jat.2717. Epub 2012 Feb 15. PMID: 22334439.